Acqua: le basi fisiche. (Prima parte)
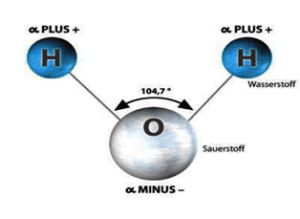
Immagine 1 : molecola dell’acqua, il più piccolo magnete
La molecola dell’acqua ha una struttura chimico-fisica molto semplice. È costituita da due atomi di idrogeno (posizionati secondo un angolo di 104,7°) ed uno di ossigeno. Questa posizione ad angolo è il risultato della carica negativa tra i due poli che si respingono. Si parla della cosiddetta repulsione elettrostatica.
L’acqua ha un comportamento diamagnetico (Il diamagnetismo è una diversa forma di magnetismo, che alcune sostanze mostrano in presenza di campi magnetici, polarizzandosi in senso opposto al campo magnetico applicato).
L’atomo di ossigeno nell’acqua ha una maggiore elettronegatività rispetto all’idrogeno, ma ha solo sei elettroni nella sua orbita esterna, e per questo motivo attrae a sé due elettroni di collegamento.
Il punto di congiunzione tra questi due elettroni è più vicino all’atomo di ossigeno, e a seguito di questa attrazione l’ossigeno si carica leggermente di carica negativa, l’idrogeno al contrario si carica leggermente di carica positiva. All’esterno l’atomo è elettricamente neutrale.
Data l’asimmetria della carica elettrica all’interno della molecola, abbiamo la formazione di un dipolo (sistema costituito da due cariche elettriche uguali e di segno opposto collocate a breve distanza l’una dall’altra), questa scoperta permise a Linus Pauling di vincere il Nobel per la fisica.
In seguito a questa formazione si formano quindi i ponti dell’idrogeno che si legano alle particelle di ossigeno e formano delle composizioni di circa 200-400 molecole. Nasce la macromolecola . Da qui risultano proprietà speciali che esulano dalla solita fisica.
Scientificamente questo fu dimostrato da Ludwig e Kokoschinegg.
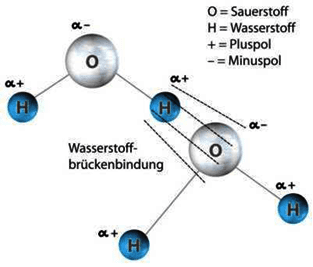
Immagine 2: idrogeno, la formazione del ponte


